

学习资源
科普文章
用于治疗HER2阳性肿瘤的在研双(多)特异性抗体
抗体生物学和工程学的进步推动了双特异性抗体的发展,双特异性抗体可以同时靶向两个不同抗原,或者靶向同一抗原上的两个不同表位。双靶点共结合的特点为双特异性抗体的临床应用带来很多可能性。因为双特异性抗体还可以通过一个结合位点靶向抗原,而另一个位点可以作为免疫靶点,从而引发协同效应。HER2作为肿瘤抗原热门靶点,针对其的双特异性抗体开发受到持续关注(表1),本文重点介绍了三款临床在研的双特异性抗体。
HER2 作为肿瘤治疗靶点的长期探索起源于25年前首个HER2 靶向药物——单克隆抗体曲妥珠单抗获得批准。从那时起,针对 HER2 的单克隆抗体、酪氨酸激酶抑制剂和抗体药物偶联物发展迅速,伴随这些疗法变革的是不断更新的临床未满足需求,这也提示着临床对于更创新和更安全有效的新疗法的持续刚需。
1.Zanidatamab(ZW25)
Zanidatamab (ZW25) 是一种针对 HER2 的 ECD IV 和二聚化结构域 (ECD II) 的人源化双特异性 IgG1 抗体,它们分别与曲妥珠单抗和帕妥珠单抗靶向的结构域相同。与每个HER2受体只能与一个抗体结合的曲妥珠单抗不同,每个 HER2 受体可以同时结合有两个 zanidatamab抗体。同理,一个zanidatamab抗体有可能同时结合在两个HER2分子上,从而促进受体聚集。因此,用 zanidatamab 治疗可促进 HER2 内化、HER2表达下调和效应功能介导的细胞毒性。作为单一疗法或与化疗联合疗法,Zanidatamab 在之前接受过HER2 治疗后复发的晚期癌症患者中显示出抗肿瘤活性。 Zanidatamab 联合 palbociclib 和fulvestrant目前正在 HR+/HER2+ 恶性乳腺癌中进行评估(NCT04224272),zanidatamab 联合ALX148(一种 CD47 阻断剂)正在 HER2高表达和 HER2低表达的乳腺癌中进行研究(NCT05027139)。另外,在HER2+ 乳腺癌中使用单药zanidatamab 进行新辅助治疗的临床试验也在筹备中(NCT05035836)。
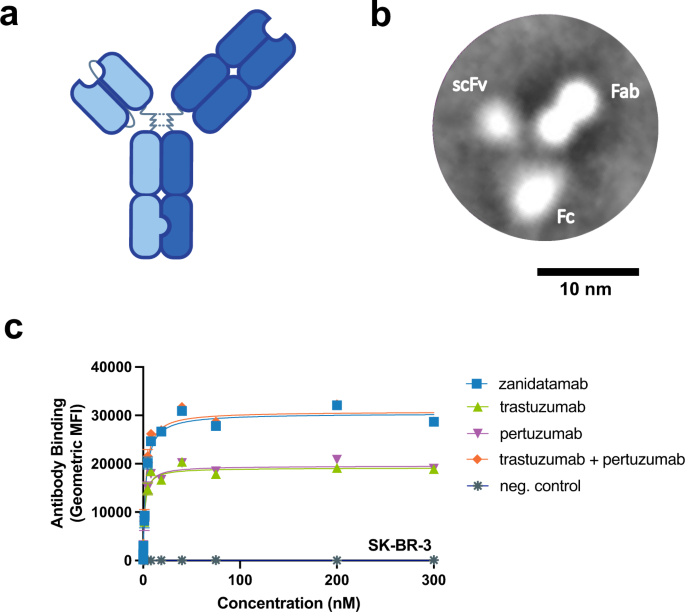
Fig.1: Zanidatamab is a biparatopic anti-HER2 Ab that binds HER2-expressing tumor cells with greater Ab saturation than trastuzumab or pertuzumab [2]
a Zanidatamab is a humanized, biparatopic, immunoglobulin 1 (IgG1)-like Ab with an scFv (light blue) that binds the juxtamembrane ECD4 of HER2 and a Fab (dark blue) that binds the ECD2 dimerization domain of HER2, the same domains targeted by trastuzumab and pertuzumab, respectively. b Representative class-averaged TEM image, derived from 216 images, showing the 3-lobed structure of zanidatamab with putative assignments of the scFv, Fab, and Fc region from a single experiment. c Zanidatamab binds with greater Ab saturation to tumor cell lines compared to trastuzumab or pertuzumab. Flow cytometry was used to quantify the binding of zanidatamab, trastuzumab, pertuzumab, and tras + pert (1:1) to SK-BR-3 tumor cells. In c, data are mean ± SEM from n = 3 independent experiments.
图 1:Zanidatamab 是一种双互补位抗 HER2 抗体,可结合表达 HER2 的肿瘤细胞,抗体饱和度高于曲妥珠单抗或帕妥珠单抗[2]
a) Zanidatamab 是一种人源化、双互补位、免疫球蛋白 1 (IgG1) 样抗体,具有结合 HER2 的近膜 ECD4 的 scFv(浅蓝色)和结合 HER2 的 ECD2 二聚化结构域的 Fab(深蓝色),靶向相同的结构域 分别通过曲妥珠单抗和帕妥珠单抗。b) 代表性的类平均 TEM 图像,源自 216 张图像,显示了 zanidatamab 的 3 叶结构,以及来自单个实验的 scFv、Fab 和 Fc 区域的假定分配。c) 与曲妥珠单抗或帕妥珠单抗相比,Zanidatamab 以更高的 Ab 饱和度与肿瘤细胞系结合。流式细胞术用于量化 zanidatamab、曲妥珠单抗、帕妥珠单抗和 tras + pert (1:1) 与 SK-BR-3 肿瘤细胞的结合。在 c 中,数据是来自 n = 3 个独立实验的平均值 ± SEM。
2.Zenocutuzumab (MCLA-128)
另一款临床在研的双特异性人源化 IgG1 抗体是 zenocutuzumab (MCLA-128),它通过两种独立的作用机制发挥作用:抑制 HER2–HER3 信号传导和通过 ADCC 消除肿瘤细胞。MCLA-128 通过“对接和阻断”机制发挥作用,其中抗体的一个臂结合 HER2 结构域 I,另一个臂结合 HER3 以阻断配体-HER3 受体相互作用,防止 HER2-HER3 二聚化和下游信号传导的激活。Zenocutuzumab 联合曲妥珠单抗和vinorelbine在 HER2+ 恶性乳腺癌患者中显示 6 个月时 35% 的临床获益率,这些患者都在先接受过抗 HER2 治疗(包括 T-DM1)并复发。zenocutuzumab 在 HER2+乳腺癌中的进一步开发方案尚不确定;然而,它结合 HER2 和阻断 NRG1 融合蛋白结合以及随后的 HER2-HER3 二聚化的特性正在 NRG1 融合基因突变阳性癌症中积极探索 (NCT02912949)。
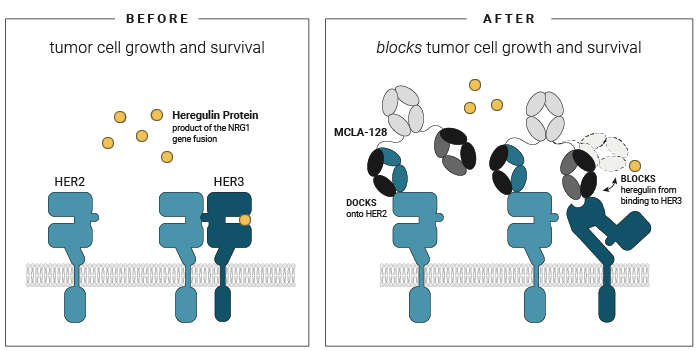
Fig.2: Zenocutuzumab (MCLA-128) works by blocking the action of the growth factor NRG1 and prohibiting it from binding to HER3 [3].
HER3 is a protein that sits on the surface of cancer cells, which when it combines with a second surface protein HER2, it sends signals to drive tumor growth and survival. NRG1 induces the combination of HER2 and HER3.
Zenocutuzumab (MCLA-128) is a bispecific antibody recognizing HER2 and HER3. Zenocutuzumab (MCLA-128) is designed to have a ‘dock and block’ mechanism:
First, zenocutuzumab (MCLA-128) docks onto HER2.
Then, it is able to block HER3’s ability to bind NRG1.
图 2:Zenocutuzumab (MCLA-128) 通过阻断生长因子 NRG1 的作用并阻止其与 HER3 结合而发挥作用[3].。
HER3 是一种位于癌细胞表面的蛋白质,当它与第二种表面蛋白质 HER2 结合时,它会发出信号以驱动肿瘤生长和存活。NRG1诱导 HER2 和 HER3 的结合。
Zenocutuzumab (MCLA-128) 是一种识别 HER2 和 HER3 的双特异性抗体。Zenocutuzumab (MCLA-128) 旨在具有“对接和阻断”机制:
首先,zenocutuzumab (MCLA-128) 结合在 HER2 上。
然后,它能够阻断 HER3 结合 NRG1 的能力。
3.KN026KN026 是一种双特异性抗体,靶向 HER2 上的两个不同表位(结构域 II 和 IV),导致双重 HER2 信号阻断,并可能促使 HER2在细胞表面聚集和内吞作用。KN026 在之前经过多线治疗的 HER2+ 晚期恶性乳腺癌患者中进行的 FIH 试验结果显示,客观缓解率 (ORR) 为 28%,中位 PFS 为 6.8 个月。转化研究表明,CDK12 和 HER2 共扩增的患者对 KN026 的反应优于没有共扩增的患者。基于这些结果,KN026用于治疗HER2+的临床试验正在进行或筹备中使(NCT04521179、NCT04881929、NCT04778982)。
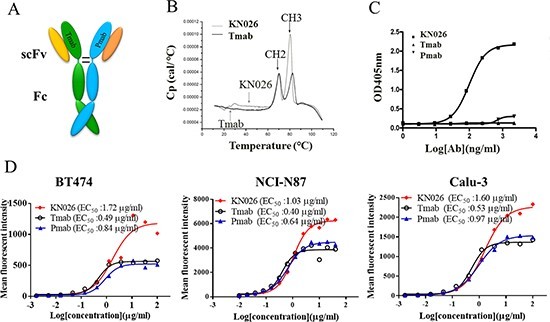
Fig 3: Construction and characterization ofanti-HER2 bsAb KN026 [4]. (A) Schematic drawing of the bsAb KN026. (B) Thermal stability ofKN026 was examined by differential scanning calorimetry (DSC). (C) Binding
affinity of KN026, trastuzumab (Tmab) and pertuzumab (Pmab) against dual
antigens was determined by sandwich ELISA. (D) The binding affinity assessment
of KN026, trastuzumab (Tmab) and pertuzumab (Pmab) to HER2 on human cancer
cells (BT474, NCI-N87, Calu-3).图 3:抗 HER2 bsAb KN026 的构建和表征[4]。 (A) bsAb KN026 示意图。 (B) 通过差示扫描量热法 (DSC) 检查 KN026 的热稳定性。 (C) KN026、曲妥珠单抗 (Tmab) 和帕妥珠单抗 (Pmab) 对双抗原的结合亲和力通过夹心 ELISA 测定。 (D) KN026、曲妥珠单抗 (Tmab) 和帕妥珠单抗 (Pmab) 与人类癌细胞(BT474、NCI-N87、Calu-3)上的 HER2 的结合亲和力评估。
表1 靶向HER2的在研双(多)特异性抗体[1]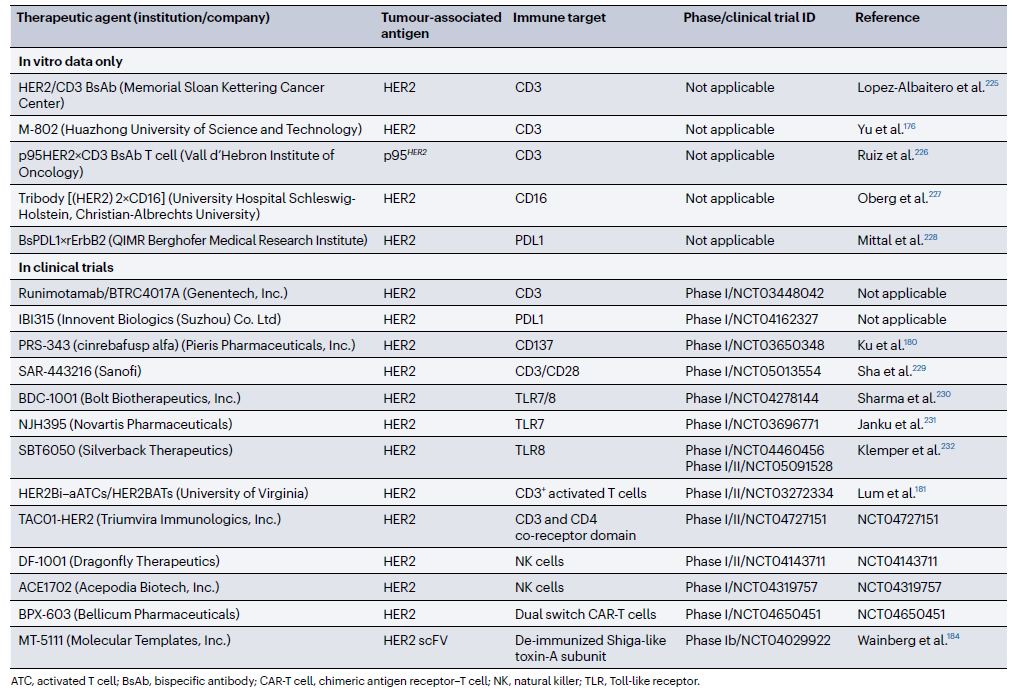
HER2 作为致癌基因、生物标志物和癌症治疗靶标,已为肿瘤患者的生存率提高做出突出贡献。这一成功源于 HER2 受体对 HER2 靶向治疗的积极应答,即使在多线治疗后仍能表现出临床应答。同时,对于HER2耐药机制的不断探索和发现为寻找新靶点,尝试新的药物机制提供了线索,为治愈 HER2+ 癌症提供了可能。越来越多的工具已经被应用于新药研发,例如人工智能、CRISPR-Cas9、单细胞测序、空间转录组学、空间蛋白质组学和治疗诊断学。不断创新完善的药物结构,如 ADC 和双特异性抗体,将持续为提高HER2+ 靶向治疗的安全性和有效性带来可能性。基于过去在 HER2 靶向治疗方面取得的成就,使我们坚信更创新的概念和应用必将在未来带来持续的突破。
本文仅作信息分享,不代表礼进生物公司立场和观点,也不作治疗方案推荐和介绍。如有需求,请咨询和联系正规医疗机构。
参考文献
1.Swain, S.M., M. Shastry, and E. Hamilton, Targeting HER2-positive breast cancer: advances and future directions. Nature Reviews Drug Discovery, 2023. 22(2): p. 101-126.
2.Weisser, N.E., et al., An anti-HER2 biparatopic antibody that induces unique HER2 clustering and complement-dependent cytotoxicity. Nature Communications, 2023. 14(1): p. 1394.
3.Geuijen, C.A.W., et al., Unbiased Combinatorial Screening Identifies a Bispecific IgG1 that Potently Inhibits HER3 Signaling via HER2-Guided Ligand Blockade. Cancer Cell, 2018. 33(5): p. 922-936.e10.
4.Wei H., C.H., Jin Y., Wang P., Zhang Q., Lin Y., Wang W., Cheng J., Zeng N., Xu T., Zhou A. ; Retrieved from Structural basis of a novel heterodimeric Fc for bispecific antibody production. Oncotarget., 2017. 8: 51037-51049.





 沪公网安备 31011502015333号
沪公网安备 31011502015333号