

学习资源
科普文章
新一代 T 细胞接合剂 (T-cell engagers,TCE)
在过去的几十年里,癌症治疗手段不断更新,其中包括基于 CD3 的双/多特异性 T 细胞接合剂 (T-cell engagers,TCE) 的开发。与传统单抗不同,TCE通过结合一个或多个肿瘤抗原表位,条件性激活病人本身T细胞,增强其对肿瘤的杀伤作用,从而达到治疗癌症的目的。TCE分子有多种构型(format),并可根据适应症特点(如肿瘤抗原的选择)进行设计。
我们将选择性地介绍几例TCE,希望可以为新一代 TCE 分子的开发提供思路。
系列三:KIMMTRAK,Immunocore gp100/CD3双特异性抗体
KIMMTRAK (IMCgp100;Tebentafusp)是Immunocore公司基于抗肿瘤免疫激动单克隆T细胞受体平台 (immune-mobilising monoclonal T cell receptor against cancer platform, ImmTAC)开发的双特异性融合蛋白。该抗体由T细胞受体(TCR)和CD3e单链可变区(scFv)融合组成,介导靶向人类白细胞抗原(HLA)亚型HLA-A* 02:01呈递的gp100肽和T细胞表面CD3,激活T细胞释放炎性细胞因子发挥对肿瘤细胞的裂解作用。用于治疗HLA-A*02:01阳性的葡萄膜黑色素瘤和恶性黑色素瘤患者。
2022年1月25日获得美国FDA批准用于HLA-A*02:01阳性成年人不可切除或转移性葡萄膜黑色素瘤患者治疗。此次授予是基于一项III期临床试验IMCgp100-202(NCT03070392)的积极数据。结果显示:接受KIMMTRAK治疗的患者将死亡风险降低了49%,且一年生存期达到了73%,优于对照治疗组。
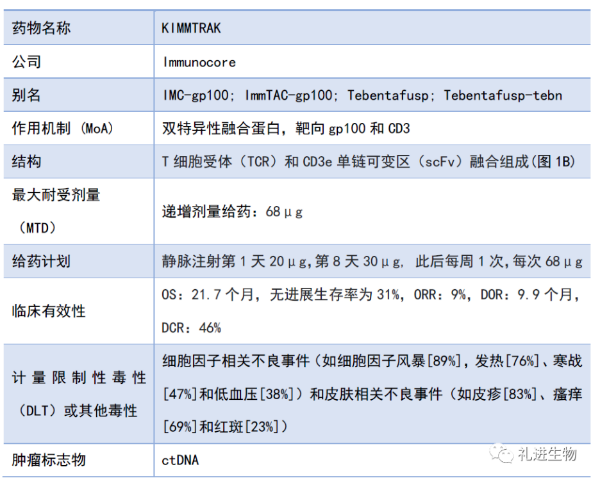
表1.KIMMTRAK 一栏表 [1]
1. 葡萄膜黑色素瘤
葡萄膜黑色素瘤(uveal melanoma,UM)是最常见的原发性眼内恶性肿瘤,由葡萄膜任何地方的黑色素细胞癌变导致。UM常见症状是视力障碍、眼睛疼痛、面部畸形和由转移导致的死亡。保眼治疗方法包括各种形式的放疗,激光治疗和手术切除,但超过50%的葡萄膜黑色素瘤患者会发生全身性转移。最常转移的部位是肝脏,少数转移到肺,骨和其他器官。研究发现UM转移后的中位生存时间约为1年。
在过去 30 年,虽然治疗该疾病的局部治疗得到发展,但是 5 年存活率并没有变化。目前没有有效的辅助治疗可以降低该疾病转移的风险。
2. ImmTAC分子平台的开发策略
抗肿瘤免疫激动单克隆T细胞受体(Immune-mobilising monoclonal TCRs against cancer,ImmTAC)平台是由Immunocore开发,一端是一个TCR靶向结构域,另一端是抗CD3e单链可变区片段scFv 结构域。TCR靶向结构域结合人白细胞抗原(HLA)-肽(pHLA)复合体上面的肽段。由HLA提呈的肽抗原可覆盖约90%的人蛋白质组,为ImmTAC分子提供了大量的潜在靶标。
为创建一个有效的ImmTAC分子,对天然TCR进行改造(图1)[1]。
首先,将膜结合的天然TCR由转变为可溶性TCR。去除跨膜结构,去除了TCR原本的链间二硫键结构,同时通过将近膜端的两个氨基酸残基突变成半胱氨酸引入人工二硫键稳定TCR结构,使TCR无法结合到细胞膜的同时维持结构稳定。即产生了一种可溶的、稳定的TCR,构成了ImmTAC分子的基础。
其次,提高TCRs与靶抗原的亲和力,将其可变区进行突变,使得亲和力提升了106倍(Kd值从μM级变成pM级)。
最后,通过在TCR结构域上融合CD3e单链可变区(scFv),ImmTAC分子具有了免疫激活功能。最终实现ImmTAC是现货式,可溶的,高亲和力TCR靶向pHLA,同时具有招募和激活CD3+T细胞裂解靶细胞的功能。
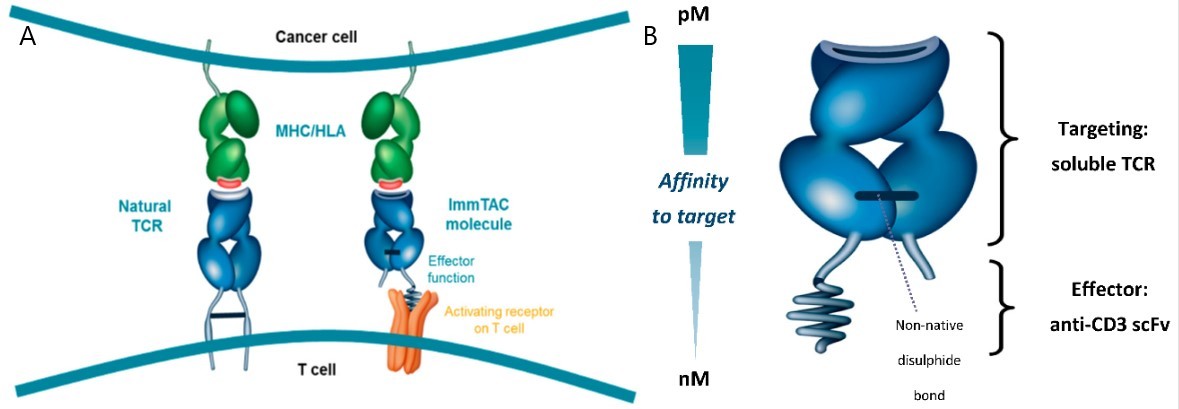
图1.A.天然TCR与ImmTAC分子平台对比 B. ImmTAC分子结构组成[1]
3. Tebentafusp 作用机制
Tebentafusp是一种针对黑色素细胞谱系特异性片段gp100208-288(YLEPGPVTA)的ImmTAC分子。糖蛋白100 (gp100),一种参与黑色素体成熟的跨膜糖蛋白,在黑色素瘤细胞中高度表达,在皮肤黑色素瘤中表达变化较大,正常黑色素细胞中低表达,而非黑素细胞则很少。Gp100208-288是细胞内gp100蛋白经蛋白酶体降解后的产物,该肽与HLA-A亚型HLA-A*02:01具有特殊亲和力,形成HLA-A* 02:01-gp100208-288肽复合体。Tebentafusp介导靶向人类白细胞抗原(HLA)亚型HLA-A* 02:01呈递的gp100肽和T细胞表面CD3,激活T细胞释放炎性细胞因子导致对肿瘤细胞的裂解作用。用于治疗HLA-A*02:01阳性的葡萄膜黑色素瘤和恶性黑色素瘤病人。基于以上机制,tebentafusp对HLA-A*02:01阴性患者无效。然而,只有约50%的白种人是HLA-A*02:01阳性,另外,根据已有流调结果推测,HLA-A*02:01阳性在中国人口占比少于20%。
Tebentafusp的临床前数据验证了上述机制数据表明,当tebentafusp与gp100阳性肿瘤细胞共孵育时,相较于缺少tebentafusp的情况,CD8+T细胞表现出细胞裂解活性并释放细胞因子。此外,裂解活性仅限于gp100和HLA-A*02:01阳性的肿瘤细胞株(图2)[1]。进一步的体外研究表明,在tebentafusp存在下,抗肿瘤活性不仅限于CD8+ T细胞, CD4+ T细胞也被定向溶解gp100阳性肿瘤细胞。Tebentafusp刺激T细胞分泌大量的肿瘤坏死因子α (TNFα)、IL-2、IL-6和干扰素γ (IFN-γ)。TNFα和IFN-γ是强促炎因子,进一步促进肿瘤细胞凋亡,招募并激活淋巴细胞,诱导树突状细胞成熟。

图2. Tebentafusp介导的CD8+ T细胞(深蓝色)杀伤gp100阳性HLA-A*02:01阳性UM细胞(红色)。gp100-阴性,HLA-A*02:01-阳性的UM(淡蓝色)被CD8+ T细胞忽略。右侧小图绿色标记细胞凋亡。[1]
4. Tebentafusp临床表现和分子应答
4.1 有效性
2022年1月25日获得美国FDA批准tebentafusp用于HLA-A*02:01阳性成年人不可切除或转移性葡萄膜黑色素瘤患者治疗。此次授予是基于一项III期临床试验IMCgp100-202(NCT03070392)的积极数据。在此项开放标签的III期试验中,以2∶1的比例将既往未经治疗的HLA-A*02:01阳性转移性葡萄膜黑色素瘤患者随机分组,共计378例患者被随机分配至tebentafusp组(252例患者)或对照组(126例患者)。两组分别接受tebentafusp(tebentafusp组)或研究者所选治疗方案帕博利珠单抗(pembrolizumab ,PD-1单抗)、伊匹单抗(ipilimumab, CTLA-4单抗)或达卡巴嗪(dacarbazine,化药)单药治疗(对照组)。主要终点是总生存期。患者第1日接受20 μg剂量tebentafusp静脉给药,第8日接受30 μg剂量,之后每周接受一次68 μg剂量。
Tebentafusp组和对照组的1年总生存率分别为73%和59%。估计中位总生存期(OS)分别为21.7个月和16.0个月(图3)。Tebentafusp组的无进展生存(PFS)率也显著高于对照组。6个月时,估计无进展生存率为31%,对照组为19%。Tebentafusp组和对照组达到客观缓解(ORR)的患者百分比分别为9%和5%。两组的中位缓解持续时间(DOR)相似:tebentafusp组9.9个月,对照组9.7个月。Tebentafusp组46%的患者疾病控制率(DCR,完全缓解、部分缓解或疾病稳定≥12周)高于对照组的27%[3]。
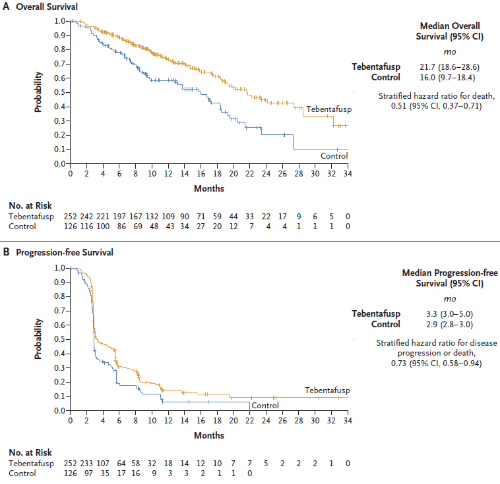
图3. 受试者总生存期和无进展生存期[2]
4.2 安全性
Tebentafusp组中最常见的治疗相关不良事件(任何级别)是细胞因子相关不良事件(如细胞因子风暴[89%]、发热[76%]、寒战[47%]和低血压[38%])和皮肤相关不良事件(如皮疹[83%]、瘙痒[69%]和红斑[23%])。Tebentafusp组109例患者(44%)和对照组19例患者(17%)报告了3级或4级治疗相关不良事件。两组中均无与治疗相关的死亡报告。Tebentafusp组大多数(57%)患者的治疗相关不良事件发生于剂量增加的最初4周治疗期间,这些事件的发生率和严重程度随着重复给药而降低[2]。
4.3 肿瘤标志物
在一项针对 127 名难治性转移性葡萄膜黑色素瘤患者的多中心、单臂、开放标签 1/2 期研究中(NCT02570308)。参与2 期研究的患者每周接受静脉给药 (i.v.) ,第 1 天 20 μg,第 8 天 30 μg,第 15 天 68 μg,然后 68 μg为固定给药剂量,每周一次,治疗周期为 4 周(28 天),在第0、 5、9 和 25 周评估 ctDNA基线和变化水平。
首先,每毫升血清ctDNA基线水平被证实与肿瘤负荷(靶病灶最长直径总和LDH指标)密切相关。ctDNA基线水平也与总生存期相关:与基线时 ctDNA 水平高于中位数的亚组相比,ctDNA 水平低于中位数的患者亚组的总生存期更长。到第 9 周时 ctDNA 减少的幅度与总生存期的改善密切相关。

图 4:治疗中 ctDNA 减少与生存获益相关[4]
a, 瀑布图显示所有可评估患者在第 9 周时 ctDNA 水平的 log10 变化(n = 94)。百分比已四舍五入到最接近的整数。b,转移性葡萄膜黑色素瘤患者在第 9 周使用 tebentafusp 的 ctDNA 减少与死亡 HR 之间的相关性(R2 = 0.9,P = 8.89 × 10-7,线性模型(双边);n = 94)。通过比较 ctDNA 高于或低于 x 轴给出的阈值的患者亚组得出风险比。c,d, Kaplan-Meier 比较 ctDNA 清除患者 (n = 12) 与未清除患者 (n = 82) 9 周的总生存期 (HR 0.08, 95% CI: 0.01–0.54, P = 4.22 × 10 −5) (c) 以及每周对 ctDNA 减少 ≥0.5 log 倍数变化(n = 16)与 <0.5 log 倍数变化(包括 ctDNA 增加的患者;n = 31)的患者对进展性疾病的最佳总体反应9(死亡 HR 0.47,95% CI:0.22–1.01,P = 0.042)(d)。b-d,风险比和置信区间是使用 Cox 比例风险模型生成的。P 值是使用双边 Cox 似然比检验生成的。
5. 商业信息
2015年4月,Immunocore与MedImmune达成临床研究合作协议,在此协议下Immunocore开展tebentafusp的1b/2期临床研究与MedImmune的durvalumab(抗PDL-1)联合使用和/或tremelimumab(抗CTLA4)用于非葡萄膜转移黑素瘤潜在治疗[3]。
2015年10月,CMC Biologics (现AGC Biologics) 和Immunocore公司就tebentafusp的转移过程和cGMP生产达成了协议。根据协议,Immunocore将tebentafusp生产工艺转让给 CMC Biologics,CMC Biologics生产tebentafusp支持Immunocore的关键临床试验[3]。
2021年10月,Immunocore与Medison Pharma就独家多地区的批准和商业化达成合作协议[3]。
6. 总结
ImmTAC分子是第一种新型的靶向T细胞的双特异性融合蛋白,利用生物工程的方法使膜结合的TCR改造成可溶性蛋白,同时提高TCR与靶抗原的亲和力,通过与CD3e scFv的融合,激活免疫系统裂解肿瘤细胞。Tebentafusp由靶向由HLA-A*02:01递呈的gp100的TCR,融合CD3e scFv构成。通过CD3招募并激活T细胞释放细胞因子和和细胞溶解介质。
Tebentafusp表现出良好的临床活性,根据III期临床试验IMCgp100-202(NCT03070392)的数据显示,接受tebentafusp治疗的患者将死亡风险降低了49%,且一年生存期达到了73%。该药物的不足之处是仅针对葡萄膜黑色素瘤罕见亚群,且临床应答率ORR仅为9%。由于仅适用于HLA-A* 02:01阳性的葡萄膜黑色素瘤和恶性黑色素瘤患者人群,对HLA-A*02:01阴性患者无效。然而, HLA-A*02:01阳性在白种人约占50%,而在中国人口占比不足20%。另外,根据tebentafusp目前临床获批剂量仅为68μg(≈0.001mg/kg)推测,其临床开发挑战之一是毒性控制。由于接受tebentafusp治疗患者普遍出现细胞因子释放综合征(89%)等免疫过激不良反应,所有病人初次给药后都需要16小时的密切住院观察,对医疗机构的软硬件条件要求较高。
综上所述,Tebentafusp为缓解葡萄膜黑色素瘤的未满足临床需求有重要意义,将TCR应用到TCE抗体领域也是创新之举,肿瘤标志物ctDNA和生存期的相关性也预示着其未来指导临床的价值。礼进生物正在积极布局新一代TCE(TAs/CD3/CD137)xLinkMsAb的开发,因为CD137(即4-1BB)会特异性激活肿瘤抗原活化过的CD8 T细胞,我们认为xLinkMsAb通过肿瘤依赖性的同时激活CD3和CD137的机制,有望进一步提升TCE的有效性。TCR对于肿瘤特异性抗原多肽特别是tumor neo-antigen的识别有特殊优势,TCR-TCE是未来极有潜力的发展方向。礼进生物正在积极寻求合作开发伙伴,希望可以借鉴tebentafusp等TCR-CD3 TCE的启发,开发新一代TCR-xLinkMsAb (TCR/CD3/CD137)。
本文仅作信息分享,不代表礼进生物公司立场和观点,也不作治疗方案推荐和介绍。如有需求,请咨询和联系正规医疗机构。
参考文献:
1. Damato, B.E., et al., Tebentafusp: T Cell Redirection for the Treatment of Metastatic Uveal Melanoma. Cancers (Basel), 2019. 11(7).
2. Nathan, P., et al., Overall Survival Benefit with Tebentafusp in Metastatic Uveal Melanoma. N Engl J Med, 2021. 385(13): p. 1196-1206.
3. Dhillon, S., Tebentafusp: First Approval. Drugs, 2022. 82(6): p. 703-710.
4. Carvajal, R.D., et al., Clinical and molecular response to tebentafusp in previously treated patients with metastatic uveal melanoma: a phase 2 trial. Nat Med, 2022.






 沪公网安备 31011502015333号
沪公网安备 31011502015333号