

新闻发布
礼进生物将在2023年ASCO上报告4-1BB激动剂临床成药性突破
礼进生物将在2023年美国临床肿瘤学会(ASCO) 年会上以墙报讨论的形式报告礼进生物CD137(4-1BB)单克隆激活性抗体LVGN6051与默沙东的PD-1抑制剂可瑞达(帕博利珠单抗)的联合治疗安全性和有效性数据,这将是4-1BB激动剂的首次临床成药性突破。
4-1BB(又称CD137)为一种重要的激活型免疫检查点分子,属于肿瘤坏死因子受体家族分子(TNFRSF)。 4-1BB主要在抗原活化后的T细胞上表达,受4-1BB配体(4-1BBL)调控激活(图1),通过下游信号通路产生共刺激信号诱导CD8+和CD4+T细胞的增殖和活性,加强免疫功能[1-3]。
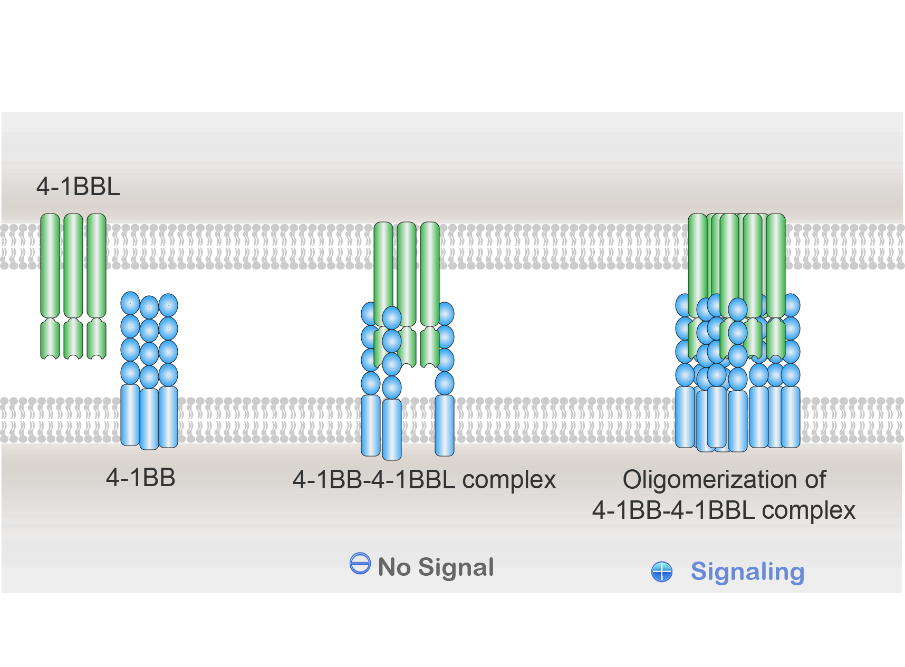
图1. 生理性TNFRSF家族4-1BB激活机制。 4-1BB受体激活机制是通过细胞之间配体(4-1BBL)和受体(4-1BB)相结合时诱导形成多聚体,受体-配体三聚体的交联和寡聚是受体下游信号激活的前提条件。这个天然调节机制保证精细的时间和空间激活信号。
现有文献记载大量的实验室和临床数据都明确支持靶向4-1BB 激动剂抗体用于癌症免疫疗法的治疗潜力。4-1BB在记忆效应CD8+T细胞上有特异性高表达,4-1BB激动剂可以在肿瘤微环境中针对性促进这类T细胞活化,提高它们与杀瘤直接相关的细胞毒性,而避免其它T细胞被激活可能带来的不良反应,从而综合提升有效性和安全性,扩大临床治疗窗口[4, 5]。另外,4-1BB被证明对于T细胞的体内长期存活率、肿瘤抗原识别的T细胞克隆丰度和免疫记忆都起重要作用。这些特性已在CAR-T领域被得到充分证实,目前6款上市CAR-T产品中的4款引入了4-1BB胞内区。同时,4-1BB激动剂还可增加NK介导的杀伤功能包括ADCC,这是它通过天然免疫系统达到抑瘤效果的另一个机制。
目前全球已有多款4-1BB激动性抗体进入癌症临床研究阶段,最早进入临床的包括BMS的urelumab和Pfizer的utomilumab。尽管两款药物早期的研发之路并不顺利,反复在疗效不足和肝毒性过大两个极端徘徊,但其长时间的临床探索,包括随后的追溯性机制研究,为新一代4-1BB激动剂研发提供了扎实的基础和线索,多款新一代肿瘤靶向的4-1BB激动剂陆续进入临床。
礼进生物专注于开发创新的肿瘤免疫疗法,利用其自主研发的交联抗体xLinkAb技术平台平衡利用候选抗体的多种功能,产生具有肿瘤靶向免疫激活功能的激动剂产品。 LVGN6051是一种条件性4-1BB 激动性双功能单克隆抗体,可在肿瘤微环境中选择性结合Fcγ 受体FcγRIIB,依赖双靶点结合引起交联以获得最佳活性(图2)[6, 7]。
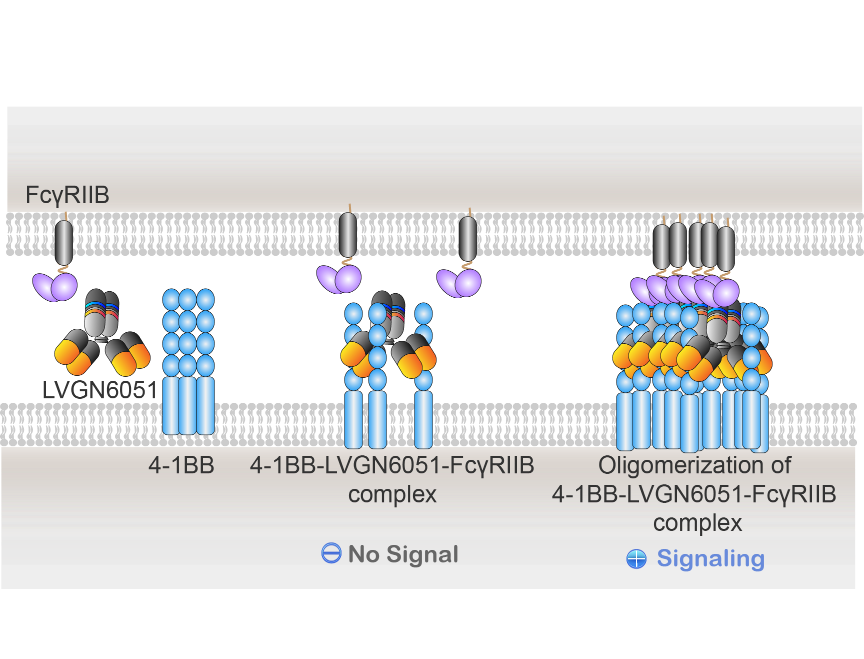
图2. 礼进生物LVGN6051 xLinkAb激动性抗体作用机制。LVGN6051单抗Fab端特异性高亲和力结合4-1BB靶点,其Fc端选择性结合FcγRIIB,产生双特异结合,通过提高整体亲和力(avidity),介导促成4-1BB—LVGN6051-FcγRIIB复合物及其交联集聚,高效激活4-1BB下游信号通路,释放其生物学功能。
LVGN6051双功能作用机制和其它在研的4-1BB双抗分子相比,有相似的靶向肿瘤微环境的设计理念,且有更天然的生物学机理和高度成熟的抗体大分子生产优势。在首例人体给药的Ia期研究中,我们探索出 LVGN6051 单药以及与帕博利珠单抗(pembrolizumab)联合使用的LVGN6051二期推荐剂量(RP2D)均为4 mg/kg, 每3周给药一次。 其临床体现出良好的耐受,并在先前免疫治疗无效或复发的患者中体现出确定的临床获益。
PD-1信号通路可以抑制 T 细胞的激活、增殖,诱导效应T 细胞的凋亡。 PD-1 抑制抗体可以恢复T 细胞的功能,激活免疫系统杀伤肿瘤,是一种广谱、长效的抗肿瘤药物[1, 2],已在多个不同类型的肿瘤中被纳入标准治疗方案。 4-1BB作为激动性受体,与PD-1等抑制性受体的“踩刹车”功能相对立协调,发挥“加油门”的作用,直接激活T细胞的抗肿瘤免疫功能(图3)。
利用细胞因子介导和细胞间接触等相互作用, 4-1BB的激活可导致PD-L1上调;而PD-1 的阻断可诱导4-1BB表达,4-1BB和PD-1胞内信号通路相互交叉,因此4-1BB激动剂和PD-1抑制剂的临床联用会产生更强大更有效的抗肿瘤免疫激活(图3)。
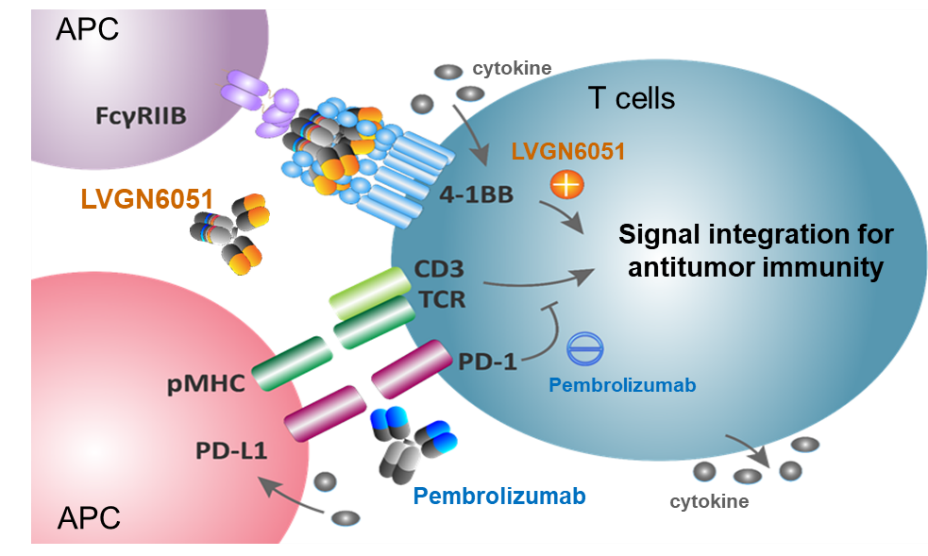
图3. 4-1BB和PD-1信号通路的交叉及4-1BB激动剂和PD-1抑制剂的协同效应。 4-1BB激活促进免疫细胞因子释放,诱导PD-L1升高和PD-1活化,而阻断PD-1活性可引起4-1BB升高。4-1BB和PD-1胞内信号通路的交叉,共同协调T细胞的抑瘤免疫功能。因此, 4-1BB激动抗体LVGN6051和PD-1抑制抗体Pembrolizumab能产生协同效应,增强免疫细胞功能。
临床前研究中, LVGN6051单药表现出极强抗肿瘤活性,且与PD-1 抗体联用时效果更强,证实了4-1BB和PD-1信号通路的协同作用机制(图3)。
临床上,LVGN6051也实现了首个4-1BB激动剂成药性的突破。 LVGN6051单药以及与PD-1抗体帕博利珠单抗(pembrolizumab) 联合中的2期推荐剂量(RP2D)均为4mg/kg,远远高于urelumab(BMS开发的第一代激动剂4-1BB单抗,受毒性限制其RP2D≤0.3mg/kg),体现出良好的临床耐受。 LVGN6051与PD-1抗体帕博利珠单抗联合使用在末线非小细胞肺癌、头颈癌、黑色素瘤、前列腺癌等多个适应症患者中均呈现明确临床获益,提示有望满足PD-1不应答或耐药的巨大临床需求。例如在经过多线免疫治疗(PD-1及CTLA-4抗体)无效或复发的黑色素瘤患者中, LVGN6051与PD-1抗体帕博利珠单抗联合治疗在早期剂量探索阶段Ia期就实现了25%的应答率(2of 8)。这是4-1BB激动剂抗体和PD-1抗体联用方案,在近10年内继utomilumab与Pembrolizumab(2014年)以及urelumab和nivolumab(2016年)之后,首次临床突破。
礼进生物将在将2023 ASCO上报告4-1BB激动剂临床成药性突破:
First-in-human, phase 1a dose finding of LVGN6051 CD137/4-1BB agonistic antibody with or without pembrolizumab in patients with advanced solid tumors.
Presenter: Adil Daud, MD | University of California-San Francisco
Abstract: 2525 | Poster Bd #: 367
https://meetings.asco.org/abstracts-presentations/220485
关于礼进生物
礼进生物是一家领先的生物科技医药公司,专注于开发创新的肿瘤免疫新药和疗法。礼进生物利用其自主研发的xLinkAb交联抗体技术平台,平衡利用候选抗体大分子的多种功能,产生具有肿瘤靶向免疫激活功能的激动剂产品。研发管线包括处于临床II期的两款极具first-in-class的激动剂单抗,以及临床前系列肿瘤抗原靶向依赖性多抗产品。目前最为领先的4-1BB(CD137)激动性抗体LVGN6051的临床安全性和活性已得到临床I期证实,与默沙东的PD-1抑制剂可瑞达®(帕博利珠单抗)联用治疗成人晚期肿瘤的Ib /II期临床试验正在美国开展。同时,LVGN6051联合血管内皮生长因子受体小分子抑制剂的II期临床试验正在中国进行。 CD40激动性抗体LVGN7409在中国和美国I期临床试验完成,已获得突破性的初步安全及有效性数据,正与美国百时美施贵宝合作开展一项开放标签多中心随机的临床II期试验,旨在评估LVGN7409 联合欧狄沃®或多西他赛对晚期/转移性非小细胞肺(NSCLC)的疗效和安全性。礼进生物自主研发PD-1抗体LVGN3616也在中美临床I期。另外,公司临床前管线布局有系列肿瘤靶向的CD3和4-1BB协同激活的多特异性抗体,这是礼进生物在现有CD3双特异性抗体T细胞接合器(T cell engager, TCE)的基础上,应用交联抗体平台开发定向激活T细胞肿瘤治疗免疫球蛋白TROY-Ig (T-cell Redirecting Oncology YukonImmunoglobulin) 系列新一代的多特异性抗体TCE。目前,公司已完成TROY-Ig平台专利申请,并已将多个候选项目推进到CMC工艺开发阶段,保障礼进生物在全球激动剂抗体领域持续保持领先。本文仅作信息分享,不代表礼进生物公司立场和观点,也不作治疗方案推荐和介绍。如有需求,请咨询和联系正规医疗机构。
参考文献
1.Chester, C., et al., Immunotherapy targeting 4-1BB: mechanistic rationale, clinical results, and future strategies. Blood, The Journal of the American Society of Hematology, 2018. 131(1): p. 49-57.
2.Shuford, W.W., et al., 4-1BB costimulatory signals preferentially induce CD8+ T cell proliferation and lead to the amplification in vivo of cytotoxic T cell responses. The Journal of experimental medicine, 1997. 186(1): p. 47-55.
3.Pollok, K.E., et al., Inducible T cell antigen 4-1BB. Analysis of expression and function. Journal of Immunology (Baltimore, Md.: 1950), 1993. 150(3): p. 771-781.
4.Horton, B.L., et al., Intratumoral CD8+ T-cell Apoptosis Is a Major Component of T-cell Dysfunction and Impedes Antitumor ImmunityApoptosis of CD8+ TILs Limits Antitumor Immunity. Cancer immunology research, 2018. 6(1): p. 14-24.
5.Melero, I., et al., Monoclonal antibodies against the 4-1BB T-cell activation molecule eradicate established tumors. Nature medicine, 1997. 3(6): p. 682-685.
6.Liu, L., et al., Antibody-targeted TNFRSF activation for cancer immunotherapy: the role of FcγRIIB cross-linking. Frontiers in Pharmacology, 2022: p. 2317.
7.Qi, X., et al., Optimizationof 4-1BB antibody for cancer immunotherapy by balancing agonistic strength with
FcγR affinity. Nature Communications, 2019. 10(1): p. 2141.




 沪公网安备 31011502015333号
沪公网安备 31011502015333号