

科普文章
继CART之后,CD20/CD3双特异性抗体也进入自免疾病领域
系统性红斑狼疮 (SLE)是严重的自身免疫性疾病,对患者的日常生活质量以及死亡风险都构成严重威胁,B细胞引发的过激免疫反应被推断是SLE诱发病因之一,关于B细胞耗尽的治疗方法在SLE中的探索一直在进行中,并且不断引入新的创新疗法,比如anti-CD19 CART和CD20/CD3双特异性抗体。小编在此与读者朋友分享一个基因泰克(Genentech)公司递交的关于用 MOSUNETUZUMAB 治疗系统性红斑狼疮 (SLE) 的方法和组合物的PCT申请(WO2023091887A1)[1],其中详细描述了通过给予莫苏奈珠单抗(mosunetuzumab)来治疗系统性红斑狼疮的临床I期试验设计和初步数据。
背景介绍
系统性红斑狼疮
系统性红斑狼疮(systemic lupus erythematosus, SLE)是一种主要发生在育龄妇女中的自身免疫性风湿性疾病。其特点是涉及多个系统和免疫异常,包括B 细胞和 T 细胞功能障碍。大多数组织损伤被认为是通过自身抗体形成和免疫复合物沉积而发生的,但根本原因仍不清楚。疾病表现范围从轻微到严重,可能危及生命,并可能表现出急性、亚急性和慢性进展模式。系统性红斑狼疮的多变性和异质性使得系统性红斑狼疮的诊断和治疗特别具有挑战性。目前系统性红斑狼疮的标准护理疗法包括口服皮质类固醇 (OCS)、抗疟疗法(如羟氯喹、氯喹和奎纳克林)和传统免疫抑制剂(如吗替麦考酚酯, mycophenolate mofetil [MMF]、硫唑嘌呤和甲氨蝶呤)。最近,B 淋巴细胞激动抑制剂贝利尤单抗(belimumab BENLYSTA) 被批准用于治疗正在接受标准治疗的处于活跃期且自身抗体阳性的系统性红斑狼疮患者。这些药物通常对系统性红斑狼疮的炎症表现不完全有效,并且它们的使用常常受到毒性的限制。例如,皮质类固醇对系统性红斑狼疮的许多表现有效,但具有显着的短期和长期副作用,包括感染、骨质疏松、高血糖和高脂血症。系统性红斑狼疮未满足的医疗需求很高。尽管存在治疗方法,但是系统性红斑狼疮患者患的累积损害、心血管疾病、治疗并发症和死亡的风险仍然很高。据估计,系统性红斑狼疮患者的死亡风险比正常对照人群高
1.3-5.3 倍。 系统性红斑狼疮也是美国年轻女性(15-24 岁)死亡的主要原因之一。莫苏奈妥珠单抗 Mosunetuzumab
Mosunetuzumab是CD20/CD3的双特异性抗体免疫球蛋白IgG1。作为一种T细胞募集双特异性抗体,mosunetuzumab是一种条件激动剂;仅当同时结合 B 细胞上的 CD20 和 T 细胞上的 CD3 时,才能观察到靶 B 细胞杀伤。
mosunetuzumab的双臂结合导致靶 B 细胞和细胞毒性 T 细胞之间形成免疫突触,从而以靶点和剂量依赖性方式激活 T 细胞。 T 细胞活化表现为活化相关表面标志物(例如CD69 和 CD25)的表达、细胞因子的瞬时释放(例如干扰素-γ [IFN-γ]、肿瘤坏死因子-a [TNF-a]、白细胞介素 [IL]-2、6 和 10)和强劲的 T 细胞增殖。随后,T 细胞通过免疫突触定向释放穿孔素和颗粒酶混合物,导致 B 细胞裂解。
1.研究依据和效益-风险评估
本专利申请中表述的Ib期研究的目的是评价mosunetuzumab在系统性红斑狼疮(SLE)患者中的递增剂量的安全性和耐受性、药代动力学和药效学,并为mosunetuzumab在如狼疮性肾炎(LN)、肾系统性红斑狼疮或其它自身免疫性疾病中的后续研究的剂量选择提供依据。
B细胞在SLE的发病机制中发挥积极作用。自身反应性 B 细胞识别并呈递自身抗原、产生自身抗体、分泌促炎细胞因子并参与T 细胞共刺激。因此,它们是SLE有吸引力的治疗靶点。然而,多个针对 B 细胞、B 细胞激活或 B 细胞存活因子的药物,包括 CD20 单克隆抗体利妥昔单抗用于治疗
SLE (StudyU2971g [EXPLORER]) 和严重 LN (Study U2970g [LUNAR])等临床随机对照组研究以失败告终。这些失败研究可能部分归因于SLE 中的 B 细胞耗竭的耐药性。最近,多队列研究已证明 SLE(特别是 LN)B 细胞耗竭的程度和持续时间与临床获益程度之间存在关联,从而支持可能需要更高水平的B 细胞耗竭才能实现疗效的假设。测试mosunetuzumab在SLE治疗中的基本原理是基于该假设。与其他抗CD20分子相比,Mosunetuzumab基于T细胞依赖性机制,更广泛地杀伤组织浸润B细胞,并且更有效地杀伤CD20表达水平非常低的B细胞,Mosunetuzumab可以实现更大程度的B细胞清除,可能最终有利于提升治疗效果。
根据其目前已知的作用机制,mosunetuzumab同时结合T细胞上的CD3和B细胞上的CD20,导致T细胞活化和随后T细胞介导的B细胞杀伤。mosunetuzumab的拟起始和最大临床剂量以及皮下给药途径是根据多种因素选择的,包括目前来自肿瘤学试验的临床安全性和有效性数据、mosunetuzumab分子特性、作用机制以及食蟹猴中的非临床安全性数据。基于目前可获得的临床安全性数据和本研究中患者群体的获益-风险考虑,待测试的mosunetuzumab第一个剂量是1.6mg皮下注射(SC),这是先前确定为安全且可耐受的药理学活性剂量水平SC 制剂对人体的影响(研究 GO29781 D 组)。队列之间的剂量递增系数约为 3 倍(图1)。
在此处添加文本段落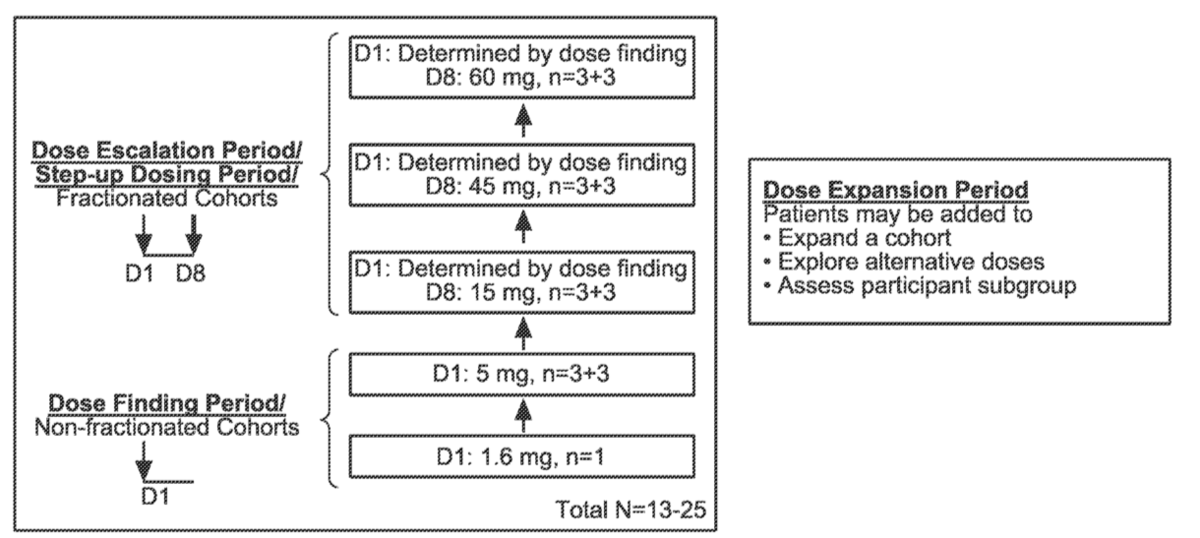
图1. 莫苏奈珠单抗(mosunetuzumab)治疗系统性红斑狼疮临床I期设计方案
细胞因子风暴(cytokine release syndrome, CRS)是所关注的主要急性毒性并且与细胞因子暴露相关。基线时循环B 细胞和 T 细胞的数量可能会提示潜在的 CRS 风险。目前,现有的临床数据表明,与复发或难治性 (R/R) B 细胞 NHL 患者(研究 GO29365)相比,SLE患者的基线 B 细胞和 T 细胞计数范围(研究 U2971g)与先前未经治疗的 B 细胞非霍奇金淋巴瘤患者(NHL;研究 GO29044)和患有先前未经治疗的弥漫性大
B 细胞淋巴瘤的老年患者(研究 GO40554 队列 B)更相似,表明 CRS 风险较低。在针对先前未经治疗的弥漫性大 B 细胞淋巴瘤老年患者(队列 B,n=40)的I/II 期研究 GO40554 中,静脉注射(IV) mosunetuzumab显示出可接受的安全性:25% 的参与者在 1/2 中出现 1 级 CRS/13.5-mg 队列(第 1 周期第 1 天 1 mg,第 1 周期第 8 天 2 mg,第 1 周期第 15 天 13.5 mg,随后后续周期(Q3W)第1 天 13.5 mg);在 1/2/30 mg 队列中,12.5% 为 1 级,9.4% 为 2 级(CCOD,2021 年 1 月 15 日)。与 IV 给药相比,SC给药可通过降低与 CRS 相关的血清中观察到的最大浓度 ( Cmax ) 来帮助减轻 CRS 风险,同时保持相似的浓度-时间曲线下面积 (AUC)。目前,研究GO29781 正在 R/R NHL 参与者中测试mosunetuzumab的 SC 给药,并且也显示出可接受的安全性。在该研究 ( Matasar et al. 2020 [2])最近对 D 组(SC 固定剂量递增)的分析中,参与者每 3 周 (Q3W)接受单药mosunetuzumab ,共 8 个周期。截至 2021 年 1 月23 日,48 名参与者接受了 1.6 至 20 mg 固定剂量的mosunetuzumab SC治疗。 29.2% 的参与者 (n=14) 发生 CRS。大多数CRS 事件(根据 ASTCT 共识分级标准进行分级)发生在第 1 周期内 (93%),所有事件均为 1 级 (n= 11;22.9%) 或 2 级 (n=3;6.3%)。在接受 mosunetuzumab SC给药的参与者中,1 名 CRS 事件接受托珠单抗治疗,2 名参与者接受低流量吸氧治疗。无需入住重症监护室或使用高流量氧气或血管加压药。值得注意的是,尽管剂量水平高出7 倍,但与 IV 固定剂量组相比,mosunetuzumab SC制剂的 2 级 CRS 事件发生率较低。数据表明,对于 R/R NHL 参与者, mosunetuzumab SC剂量 1.6-20 mg 的安全性可控(请参阅mosunetuzumab研究者手册)。逐步分次给药可以通过降低Cmax同时维持 AUC 来进一步降低CRS 事件的发生率和严重程度。研究 GO29781 的 F 组正在 NHL 参与者中评估逐步给药方案。截至 2021 年 1 月 23 日,初始5/15/45 mg 队列(分别在第 1/8/15 天进行第 1 周期 5/15/45 mg 逐步给药,随后进行第 3 周给药)已被清除,最大剂量未达到耐受剂量(MTD)。在接受第1 周期升级 5/15/45 mg SC mosunetuzumab治疗的 8 名参与者中,有 3 名参与者 (37.5%) 报告发生 CRS。全部为 1 级(n=1;12.5%)或2 级(n=2;25.0%)。两名参与者接受了托珠单抗治疗,没有参与者需要补充氧气、血管加压药或进入重症监护室。已在肿瘤患者中研究了 1/2/60 mg 的最大IV 递增临床剂量。为了进一步支持 60 mg 的最大剂量水平,使用探索性定量系统药理学 (QSP) 模型来模拟 mosunetuzumab 给药后 60 天的全身B 细胞动力学时程。 QSP 模型中的全身 B 细胞耗竭和反弹是根据 mosunetuzumab 在食蟹猴中的非临床数据实施和验证的。为了预测 SLE 患者的循环B 细胞动力学,首先通过将生理参数(即组织区室体积和每个区室中的细胞计数)和mosunetuzumab PK 特性更改为人类值,将模型表示从食蟹猴转化为人类。然后,将研究U2971g 中 SLE 患者的基线循环 B 细胞和 T 细胞应用于外周血室。对高达 60 mg 的计划剂量进行的基于模型的模拟表明,B 细胞耗竭的持续时间呈剂量依赖性增加(<5 个细胞/ pL ) ,并且在 60 mg 剂量下,超过 90% 的模拟患者可以将 B 细胞消除维持 60 天。
2.研究设计
这是一项 Ib 期多中心、开放标签、剂量递增研究,以评估mosunetuzumab在患有SLE 的参与者中的安全性、耐受性、药代动力学和药效学。该研究将在全球约 15 个研究中心招募最多 50 名 SLE 参与者。在剂量探索和剂量递增期间将招募大约13-25 名参与者。在 DLT 评估期间因 DLT 之外的任何原因退出的参与者将被替换。在剂量扩展期间可以添加额外的参与者以替换过早停止的参与者、扩大现有的剂量队列、以修改的剂量填充队列或评估感兴趣的特定亚组(例如,接受特定允许的SLE 背景治疗的参与者) 。图 1 和图 2 概述了研究设计。
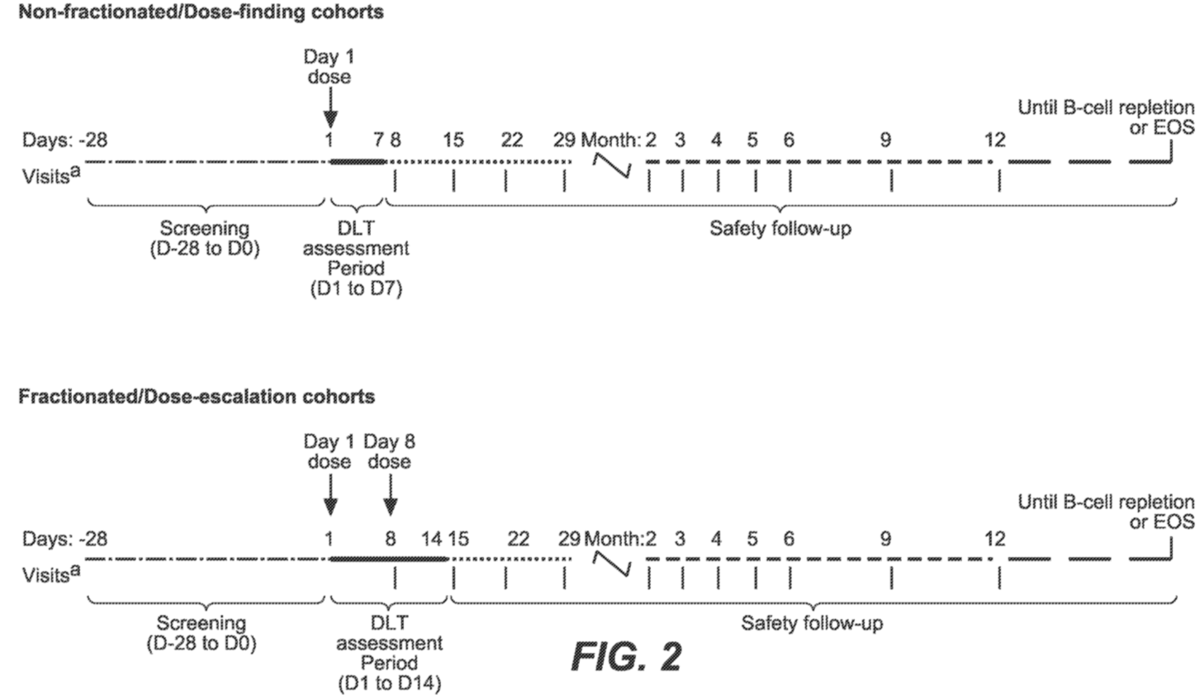
图2. 研究时间表
DLT = 剂量限制性毒性; EOS = 研究结束,不显示 DLT 评估期内的访问以及第 12 个月之后的访问。
3.研究目标和终点
该临床试验被设计为评估 mosunetuzumab 在SLE患者受试者中的安全性、耐受性、药代动力学和药效学。关于探索性活动的目标,即根据以下终点评估 mosunetuzumab 对 SLE 参与者的临床反应。
3.1 主要安全目标
本研究的安全性目标是评估 mosunetuzumab 的安全性,包括给药方案和剂量的耐受性,以及基于以下终点的剂量限制毒性(DLT)的表征:
• 不良事件(包括 DLT)的发生率和严重程度,严重程度根据国家癌症研究所不良事件通用术语标准 (NCI CTCAE) v5.0 确定,细胞因子释放综合征 (CRS) 严重程度根据 2019 年美国移植学会确定和细胞治疗 (ASTCT) CRS 共识分级标准
• 目标生命体征较基线的变化
• 目标临床实验室测试结果相对于基线的变化
3.2 药代动力学目标
本研究的药代动力学(PK)目标是基于以下终点表征 mosunetuzumab 的分次和非分次单剂量给药的PK概况:
• 特定时间点 mosunetuzumab 的血清浓度
• mosunetuzumab的 PK 参数
本研究的探索性PK目标是基于以下终点评估 mosunetuzumab 的药物暴露、药效学和安全性之间的潜在关系:
• mosunetuzumab的血清浓度或PK 参数、药效学和安全性终点之间的关系
3.3药效学目标
本研究的药效学(PD) 目标是根据以下终点来表征 mosunetuzumab 对 SLE 参与者的 PD 作用:
• 特定时间点的外周 B 细胞计数
• B 细胞耗竭的持续时间
3.4免疫原性目标
本研究的免疫原性目标是基于以下终点评估对mosunetuzumab的免疫应答:
• 基线时抗药物抗体 (ADAs) 的流行率以及研究期间 ADAs 的发生率
• 本研究的探索性免疫原性目标是基于ADA 状态与安全性、PK 和生物标志物终点之间的关系,评估 ADAs 的潜在影响
3.5探索性活动目标
• 患者对严重程度的总体印象 (PGI-S)
• 医师整体评估(PGA)
• 抗核抗体 (ANA) 和抗双链 DNA (dsDNA) 抗体 (IgG) 滴度相对于基线滴度的变化
• 补体 C3 相对于基线的变化
• 补体 C4 相对于基线的变化
3.6 探索性生物标志物目标
本研究的探索性生物标志物目标是鉴定和/或评价与发生不良事件的易感性相关或可导致改善的不良事件监测或研究的生物标志物(即,安全性生物标志物),可提供 mosunetuzumab 活性的证据(即 PD 生物标志物)或可以基于以下终点增加对疾病生物学和药物安全性的知识和理解:
• 血液、血浆和血清中的生物标志物与PD、安全性、PK 或其他之间的关系
•生物标志物终点
• 血液、血浆和血清中生物标志物之间的关系及其机制
• mosunetuzumab的作用
• 给予mosunetuzumab后在指定时间点检测自身抗体效价变化(抗史密斯抗原[Sm]、抗Sjbgren综合征相关抗原A[ SSA]、抗夏布格伦综合征相关抗原 B [SSB] 和抗核糖核蛋白 [RNP])
• mosunetuzumab给药后特定时间点CRS 相关生物标志物的变化
• mosunetuzumab给药后特定时间点T 细胞亚群的变化
3.7其他探索性目标
另一个探索性目的是基于以下终点评估托珠单抗(tocilizumab)在 mosunetuzumab 治疗后治疗严重细胞因子释放综合征(CRS)中的功效:
• CRS 事件结果和事件持续时间
• 托珠单抗治疗CRS后细胞因子水平、CRS 相关生物标志物和临床实验室值的变化。
4.初步临床研究结果
4.1 功效数据
在第1天(5mg)和第8天(15mg)接受分次给药的三名患者中的两名已表现出在初始5mg给药后持续90天的持续外周B细胞耗竭,并且迄今为止有1名患者在第1天接受分次给药第1天(5mg)和第8天(45mg)已证明在初始5mg给药后至少30天持续外周B细胞耗竭(参见图3,迄今为止无法获得5-45队列中第二个参与者的数据)。
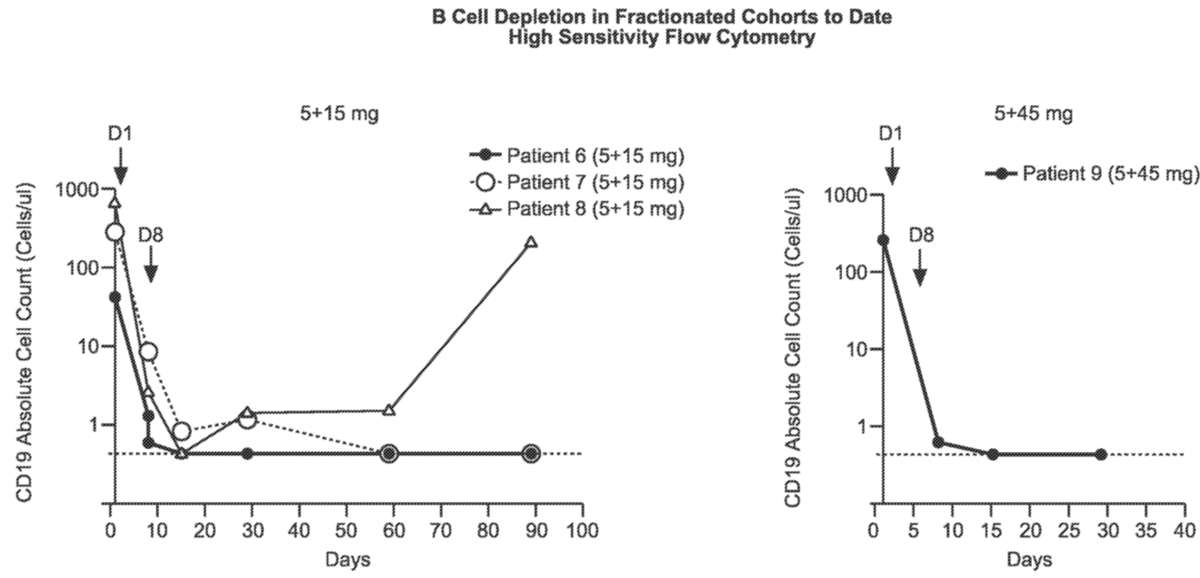
图3. 分级群组中的B细胞消耗
定量下限为 < 0.441 个细胞/pL
迄今观察到在第1天(5mg)和第8天(15mg)接受分次给药的一名患者抗双链DNA(dsDNA)抗体(IgG;图4)减少。值得注意的是,抗 dsDNA 抗体滴度的降低已被证明与狼疮性肾炎患者疾病活动性的改善相关。
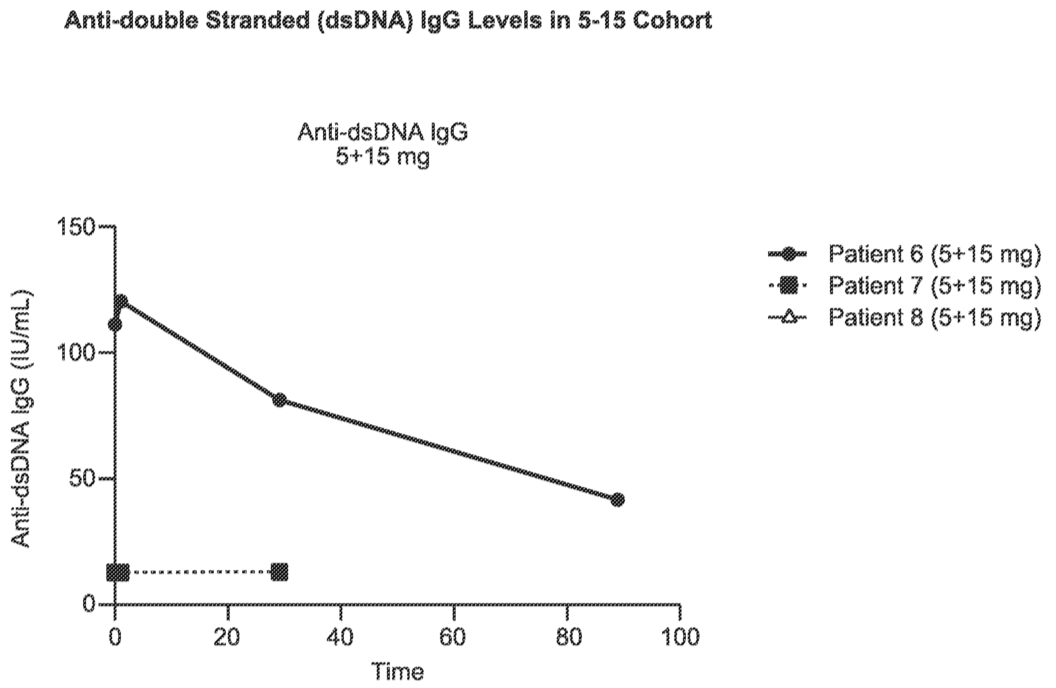
图4. 患者的抗双链(dsDNA)抗体(IgG)水平
4.2 安全性和耐受性数据
迄今为止,尚未出现严重不良事件或剂量限制性毒性(DLT,定义为CTCAE 3级或更高)。
所有不良事件都是1级或2级(非严重)。没有出现临床相关的实验室异常或临床相关的心电图(ECG)变化。
Mosunetuzumab除了B细胞耗竭之外,还导致T细胞边缘化,导致称为淋巴细胞减少症或淋巴细胞计数减少的短暂淋巴细胞减少。在第一部分剂量 (5 mg) 后,所有 11 名患者均观察到了这种效应,并且通常对 T 细胞双特异性抗体有很好的描述。所有 11 名患者在第一次莫苏奈妥珠单抗施用后观察到绝对淋巴细胞计数短暂减少,并在大约 2 周内恢复到基线值(图5显示了基于数据截止日期的前 8 名患者的数据)。
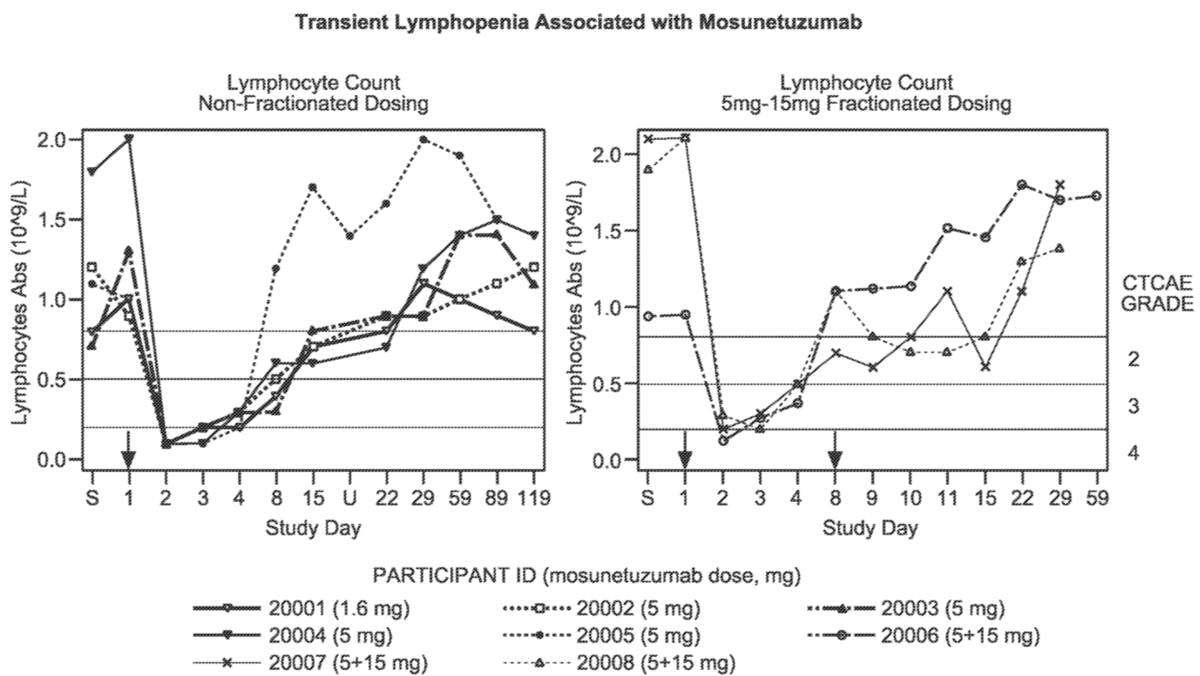
图5. 受试患者的短暂性淋巴细胞减少症相关的安全性数据的总结
有趣的是,对于接受分次剂量的患者来说,与第一次给药(第 1 天)后相比,第 8 天给药后没有观察到淋巴细胞计数减少,或者观察到淋巴细胞计数减少的程度较小。重要的是,没有与这些短暂的淋巴细胞减少相关的临床体征或症状,并且研究研究者没有将这些异常实验室值视为不良事件。这一决定是基于研究人员的医学和科学判断。
总结
随着anti-CD19 CART 在红斑狼疮的积极临床数据的公布[3],我们逐渐观察到CD3双特异性抗体在自免领域的探索,包括最新IGM Biosciences, Inc. (Nasdaq: IGMS)公司于今年5月宣布,其 IgM-based CD20 X CD3 bispecific antibody T cell engager, imvotamab已获得FDA批准,开展治疗严重系统性红斑狼疮severe systemic lupus erythematosus (SLE)和严重风湿性关节炎severe rheumatoid arthritis的临床Ib期研究,公司计划2023年第三季度启动患者招募[4]。礼进生物作为肿瘤免疫激动剂抗体开发领域的领军者之一,临床前开发阶段的B细胞相关淋巴瘤后续物分子anti-CD19/CD20/CD3/4-1BB多特异性抗体也具备开拓自免领域的潜力,且比现有anti-CD19或anti-CD20单一抗原、或者CD3双特异性抗体有更大的临床治疗窗口(基于4-1BB对于cytotoxitic T细胞的特异激动活性),正积极寻求对外合作机会。
本文仅作信息分享,不代表礼进生物公司立场和观点,也不作治疗方案推荐和介绍。如有需求,请咨询和联系正规医疗机构。
参考文献:
1.PCT International publication number WO2023091887A1/International application number: PCT/US2022/079787
2. Matasar MJ, Cheah CY, Yoon DH, et al. Subcutaneous mosunetuzumab in relapsed or refractory B-cell lymphoma: promising safety and encouraging efficacy in dose escalation cohorts [abstract] Presented at the 2020 American Society of Hematology Annual Meeting 6 December 2020:session 626.
3.Mackensen A, Müller F, Mougiakakos D, Böltz S, Wilhelm A, Aigner M, Völkl S, Simon D, Kleyer A, Munoz L, Kretschmann S, Kharboutli S, Gary R, Reimann H, Rösler W, Uderhardt S, Bang H, Herrmann M, Ekici AB, Buettner C, Habenicht KM, Winkler TH, Krönke G, Schett G. Anti-CD19 CAR T cell therapy for refractory systemic lupus erythematosus. Nat Med. 2022 Oct;28(10):2124-2132. doi: 10.1038/s41591-022-02017-5. Epub 2022 Sep 15. Erratum in: Nat Med. 2022 Nov 3;: PMID: 36109639.
4.IGM Biosciences Announces FDA Clearance to Begin Clinical Studies of Imvotamab in Lupus and Rheumatoid Arthritis
https://www.igmbio.com/






 沪公网安备 31011502015333号
沪公网安备 31011502015333号